Clasificación de las Lesiones Escamosas Intraepiteliales e Invasoras de la Vulva
(Sociedad Argentina de Patología):
Dra. Alejandra Wernicke. Hospital Italiano de Bs As. Servicio de Anatomía Patológica
Dra. Marie Catherine Saez Perrotta. Hospital Italiano de Bs As. Servicio de Anatomía Patológica
Sociedad Argentina de Patología -SAP-
Neoplasias intraepiteliales escamosas de la Vulva (SIL): Clasificación Histológica
Existen dos tipos diferentes de neoplasias intraepiteliales vulvares (VIN) considerados precursores inmediatos del carcinoma de células escamosas de la vulva (CCE) e incluidas en la clasificación histológica propuestas por la Sociedad Internacional para el estudio de la patología Vulvo-vaginal (ISVVD) y por la Clasificación de Tumores de la 5ta Edición de la OMS [3] (Tabla 1).
- Lesión intraepitelial escamosa de la vulva HPV relacionada (SIL):
- Lesión intraepitelial escamosa de bajo grado (LSIL, efecto citopático viral): Infección transitoria por HPV que regresa de manera espontaneo y que no presenta un riesgo de progresión. No se trata.
- Lesión intraepitelial escamosa de alto grado (HSIL, VIN usual): Relacionada con el virus del papiloma humano (VPH) de alto riesgo, que comprende más del 80% de las VIN, pero menos del 50% de los casos de CCE [1-2-6]. Baja tasa de progresión,5% aproximadamente.
Neoplasia intraepitelial escamosa vulvar HPV independiente - VIN diferenciado (VINd):
Lesión independiente del VPH y que generalmente muestra una morfología queratinizante, sobre un fondo de liquen escleroso (LE) [7-11]. La edad media al diagnóstico varía de 67 a 78 años. [1,4]. Es considerado el verdadero precursor del cáncer de vulva, con una tasa de progresión del 35% aproximadamente.
Lesión exofitica intraepitelial diferenciada de la vulva (DE-VIL):
Lesión HPV independiente infrecuente caracterizada por acantosis verruciforme con hipogranulosis y maduración abrupta citoplasmática que se diferencia del HSIL y del VINd por la ausencia de atipia en la basal.
Tabla 1: Lesiones Neoplásicas Vulvares HPV asociadas vs HPV independinetes
|
|
HPV asociado |
HPV independiente |
|
Tipo de lesión |
HSIL |
VINd y DEVIL |
|
Edad |
40-60 |
50-70 |
|
Etiología |
HPV Alto Riesgo |
Inflamación crónica (LE) |
|
Biomarcadores |
P16 |
P53 |
|
Evolución |
Favorable |
Menos Favorable |
Hallazgos Clinicos
El VINd se presenta frecuentemente como una lesión blanquecina grisácea unifocal que ocurre comúnmente en la región peri clitoridiana, labios menores y áreas de piel sin pelo revestidas por epitelio escamoso no-queratinizado. En contraste, la neoplasia relacionada con el VPH se presenta como una lesión pigmentada multifocal que ocurre con mayor frecuencia en el periné [4]. El DEVIL al igual que el VINd se presenta como lesiones únicas blancas hiperqueratosicas.
Hallazgos Histológicos:
Desde el punto de vista histológico el HSIL comúnmente muestra células atípicas que comprometen todo el espesor del epitelio de núcleos grandes, hipercromáticos y escasos citoplasma basófilo, que le da al epitelio una apariencia azul obviamente diferente al epitelio no neoplásica adyacente (Figura 1) [10-11].
El VINd (Fig. 3) muestra alteraciones arquitecturales caracterizadas por epitelio con acantosis y maduración citoplasmática anómala y atipia citológica y mitosis limitadas a la basal. Es importante resaltar que la atipia de la neoplasia intraepitelial HPV-independiente es mucho más sutil en comparación con la atipia del HSIL. El VINd a menudo recapitula el color rosado y el patrón de maduración visto en condiciones benignas como LE y el liquen simple crónico (LSC).
El DEVIL se presenta como una lesión verruciforme con acantosis, hiperqueratosis y maduración citoplasmática abrupta dándole un característico color rosado al epitelio. La ausencia de atipia es lo que lo diferencia del HSIL y el VINd.
Evolución de la enfermedad y Biomarcadores:
Existen múltiples publicaciones que muestran ciertas deficiencias en el diagnostico histológico del VIN. Se considera globalmente que el 10-25% de las neoplasias vulvares está mal clasificada cuando el diagnóstico se basa en la combinación tradicional de factores de riesgo clínico y categorización morfológica [12]. Esto es especialmente valido para los casos de VINd [8]. Por el contrario, HSIL suele ser un diagnóstico más sencillo histológico [11].
La proteína p16 analizada con técnicas de inmunohistoquímica (IHQ) surgió como un biomarcador confiable para el diagnostico de HSIL asociado a infección por HPV (Figura 2). El proyecto LAST (Lower Anogenital Squamous Terminology Project) define una marcación positiva como una tinción continua e intensa en los núcleos y el citoplasma de al menos los dos tercios inferiores [11]. El segundo marcador de utilidad diagnostica y pronostica es el p53 el cual surge como una herramienta complementaria para el diagnóstico del VINd, sobre todo en su diferenciación con ciertas dermatosis vulvares como LE hipertrófico y LSC (Figura 4). El diagnóstico de dVIN requiere atipia basal en combinación con una marcación negativa para p16 y expresión aberrante para el p53 (patrón mutado).
El DEVIL presenta marcación negativa para el p16, mostrando un patrón de expresión no mutado o conservado para el p53. Se considera una lesión asociada al carcinoma verrucoso.
Distinguir entre los precursores relacionados con el VPH y los independientes del VPH tiene importantes implicancias para el tratamiento y el pronóstico. El tratamiento de VINd es la escisión, mientras que las opciones para HSIL incluyen imiquimod, LASER y escisión.
La vigilancia, diagnóstico y tratamiento del HSIL está dentro del alcance de la mayoría ginecólogos, mientras que la evaluación de VINd y ciertas dermatosis vulvares requieren habilidades y experiencia especifica en patología dermatológica vulvar. [1]. El diagnóstico correcto es esencial para la atención clínica directa.
Figura 1: H&E: 10X. Microfotografía con HSIL pigmentado. Figura 2: Tinción positiva para p16 por IHQ.
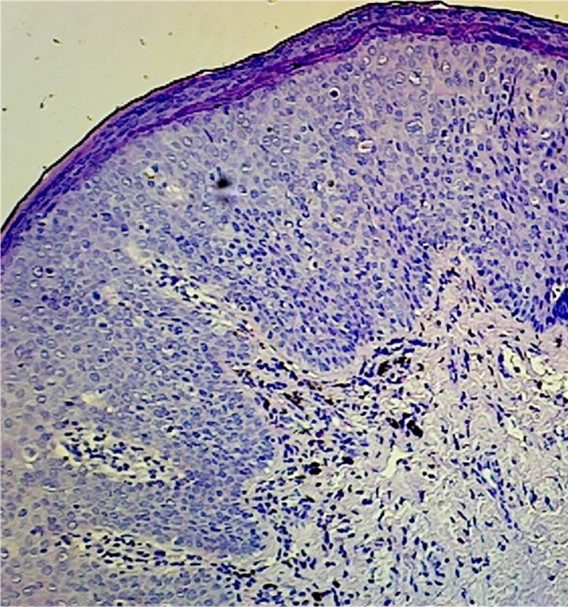

Figura 3 y 4: VINd por H&E y maracion con p53 positiva basal y continua por IHQ.


Bibliografía
- Eva LJ, Sadler L, Fong KL, Sahota S, Jones RW, Bigby S. Trend in HPV-dependent and HPV-independent vulvar cancers: the changing face of vulvar squamous cell carcinoma.
Gynecol Oncol 2020;doi.org/10.1016/j.ygyno.2020.01.029. - de Sanjose S, Alemany L, Ordi J et al. Worldwide human papillomavirus genotype attribution in over 2000 cases of intraepithelial and invasive lesions of the vulva. Eur J Cancer 1990;49:3450-3460.
- WHO Classification of Tumours of Female Reproductive Organsis the sixth volume in the 5th Edition of the WHO series on histological and genetic typing of human tumors. 2020.
- Hinten F, Molijn A, Eckhardt L et al. Vulvar cancer: two pathways with different localization and prognosis. Gynceol Oncol 2018;149:310-317.
- Kashofer K, Regauer S. Analysis of full coding sequence of the TP53 gene in invasive vulvar cancers: implications for therapy. Gynecol Oncol 2017;146:314-318.
- Preti M, Scurry J, Marchitelli CE, Micheletti L. Vulvar intraepithelial neoplasia. Best Pract Res Clin Obstet Gynaecol 2014;28:1051-1062.
- Scurry J, Campion M, Scurry B, Kim SN, Hacker N. Pathologic audit of 164 consecutive cases of vulvar intraepithelial neoplasia. Int J Gynecol Pathol 2006;25:176-181.
- van de Nieuwenhof HP, Bulten J, Hollema H et al. Differentiated vulvar intraepithelial neoplasia is often found in lesions, previously diagnosed as lichen sclerosus, which have progressed to vulvar squamous cell carcinoma. Mod Pathol 2011;24:297-305.
- Kokka F, Singh N, Faruqi A, Gibbon K, Rosenthal AN. Is differentiated vulval intraepithelial neoplasia the precursor lesion of human papillomavirus-negative vulval squamous cell carcinoma? Int J Gynecol Cancer 2011;21:1297-1305.
- Cohen PA, Anderson L, Eva L, Scurry J. Clinical and molecular classification of vulvar squamous pre-cancers. Int J Gynecol Cancer 2019;29:821-828.
- Dasgupta S, Ewing-Graham PC, Swagemakers SMA et al. Precursor lesions of vulvar squamous cell carcinoma – histology and biomarkers: a systematic review. Crit Rev Oncol Hematol 2020;147: 102866.
- Rakislova N, Alemany L, Clavero O, et al. Differentiated vulvar intraepithelial neoplasia-like and lichen sclerosus-like lesions in HPV-associated squamous cell carcinomas of the vulva. Am J Surg Pathol 2018;42:828-835.
Carciona Escamoso de la Vulva:
El carcinoma de células escamosas de vulva es la neoplasia maligna más frecuente de la vulva y constituye aproximadamente el 5% de todos los cánceres ginecológicos [1]. “Carcinoma de células escamosas” es un término genérico que se utiliza para describir todas las neoplasias que surgen del epitelio escamoso de la vulva; sin embargo, diferentes variantes se asocian a pronósticos drásticamente diferente para las pacientes con esta enfermedad.
El carcinoma de células escamosas vulvar puede surgir a través de dos vías patogénicas distintas [asociado al virus del papiloma humano (VPH) e independiente del VPH]- Tabla1, y estas variantes de se reconocen como entidades diferentes sobre la base de diferentes etiologías, características morfológicas y eventos moleculares durante la oncogénesis, lesiones precursoras, pronóstico y respuesta al tratamiento.
En consecuencia, La Organización Mundial de la Salud (OMS), en el 2020 modifica la clasificación morfológica clásica de los carcinomas escamosos de la vulva para incorporar estas importantes diferencias en la patogenia y el comportamiento.
Clasificación del carcinoma escamoso vulvar, OMS 2020[2]:
- Carcinoma Escamoso de la vulva, HPV relacionado
- Carcinoma Escamoso de la vulva, HPV independiente
- Carcinoma Escamoso de la vulva, NOS
- Variantes Especiales de Carcinomas escamosos:
- Carcinoma Basaloide, Carcinoma, HPV relacionado
- Carcinoma Condilomatoso/Warty, Carcinoma HPV relacionado
- Carcinomas Verrucoso, Carcinoma HPV independiente
- Carcinoma Escamoso de la vulva, HPV relacionado:
Clínica: No es sorprendente los Carcinoma escamosos HPV- asociados compartan muchas características epidemiológicas con el carcinoma del cuello uterino. Ocurren principalmente en mujeres relativamente jóvenes y tienen los mismos factores de riesgo de desarrollo y progresión que las lesiones cervicales, mostrando una fuerte asociación con el número de parejas sexuales, el hábito de fumar y el estado inmunológico deteriorado.
Los carcinomas escamosos HPV asociados representan el 25% de los carcinomas escamosos de la vulva [1] con variaciones según la serie. Estos pacientes parecen tener un pronóstico significativamente mejor que el grupo de pacientes más añosas con tumores HPV negativos[2].
Características macroscópicas: Lesiones frecuentemente exofíticas, alta frecuencia de multifocalidad.
Características microscópicas: Frecuentemente, los carcinomas escamosos de la vulva HPV-asociados son moderadamente a pobremente diferenciados. Se reconocen distintas variantes histopatológicas como el tipo basal, carcinoma condilomatoso (ver subtipos especiales)- Fig. 1A- Sin embargo, un tercio de los carcinomas escamosos HPV asociados son de tipo queratinizante[3].
Debido a la superposición morfológica con carcinomas HPV independientes, es esencial para el diagnóstico correcto el uso de técnicas complementarias como inmunohistoquímica para p16INK4A.-Fig.1B-
Pronóstico y Biomarcadores: El carcinoma de células escamosas de la vulva HPV asociado pareciera tener un pronóstico más favorable, menor tasa de recaídas y mejor respuesta a la radio terapia en comparación al HPV independiente. El pronóstico en estadio temprano es bueno con una sobrevida a los 5 años del 80-90%. El estadio y el estatus ganglionar serían los factores pronósticos más importantes.
No es posible clasificar con precisión al VSCC como asociado al HPV o independiente del HPV sobre la base de características clínicas e histopatológicas, con un 10-20% de los casos clasificados erróneamente. Por lo que idealmente la presencia del HPV debería de ser confirmada con técnicas de biología molecular o inmunohistoquímica (p16):
Una prueba ampliamente utilizada subrogante de integración del genoma viral a la célula huésped es la inmunotinción para p16INK4A (p16). Se reconoce que el patrón de tinción en 'bloque', definida como la tinción intensa nuclear y citoplasmática de todas las células, constituye un resultado anormal, y que dicho patrón inmunohistoquímico es un marcador sensible y específico de infección transformante por HPV de alto riesgo en carcinomas escamoso vulvares y sus precursores[4].
La detección del ADN del virus por ejemplo con técnicas de PCR, incluso cuando se detectan genotipos oncogénicos, puede reflejar un hallazgo incidental, no relacionado con la enfermedad subyacente, dada la alta prevalencia del VPH. Por tanto, estas pruebas son sensibles, pero menos específicas.
Carcinoma Escamoso de la vulva, HPV independiente:
Clínica: El pico de incidencia de estos tumores en entre la 7ma y 8va década de la vida, son tumores típicamente asociados con liquen escleroso y liquen plano. Con mayor frecuencia se presentan en estadios avanzados al momento del diagnóstico.
Características macroscópicas: Lesiones frecuentemente exofíticas, frecuentemente ulceradas en contexto de vulvas con signos clínicos de liquen escleroso y dVIN.
Características microscópicas: Típicamente este grupo de carcinomas se presentan como carcinomas escamosos queratinizantes bien diferenciados con formación frecuente de perlas córneas profundas. En general muestran un patrón de invasión expansiva, aunque también se reconocen carcinomas con patrón destructivos de invasión del estroma.
Pronóstico y Biomarcadores: El subgrupo de carcinomas escamosos HPV independientes con frecuencia albergan mutaciones de TP53 y presentan un peor pronóstico. La mayoría de estas mutaciones son mutaciones sin sentido que dan como resultado la acumulación de p53 mutante en los núcleos de las células tumorales; aunque la proteína no es funcional, es resistente a la degradación. Dichas anomalías moleculares se pueden evidenciar como patrones aberrantes de expresión inmunohitoquimica de la p53.
Los carcinomas escamosos vulvares HPV independientes / P53 no mutados (salvaje- normal) representaría un tercer subgrupo clínico-patológico distinto. Distintos trabajos empiezan a evaluar en profundidad alteraciones moleculares potenciales de este grupo de carcinomas y sugieren una tercera vía en la carcinogénesis del cáncer de vulva -tabla 2- con lesiones precursoras especificas (DE-VIL) e identidad molecular particular (mutación de Notch y PIK3CA). La identificación de esta tercera subclase molecular tiene relevancia para el refinamiento del riesgo, ya que presentan una tasa de recurrencia local menor, independiente de las variables clínico-patológicas[5].
Carcinoma Escamoso de la vulva, NOS:
Las características morfológicas de los carcinomas escamosos de la vulva no son criterios fidedignos para su clasificación etiológica, por lo que se recomienda la utilización de técnicas complementarias para la correcta clasificación de los carcinomas escamosos vulvares. La sobreexpresión de p16 con técnicas de inmunohistoquímica resulta un marcador subrogante sensible para el diagnóstico de carcinoma escamosos HPV asociados. Se acepta entonces el diagnóstico de Carcinoma Escamoso NOS cuando no se cuenta con la posibilidad de realizar técnicas de IHQ para p16.
Carcinomas especiales de la vulva:
- Carcinoma Basaloide: Forma parte del espectro de carcinomas escamosos HPV- asociado. Sin embargo, las características histomorfológicas no son suficientes para definirlos como carcinomas HPV asociados y es necesaria la utilización de técnicas complementarias que evidencien la infección transformante por virus de HPV de alto riesgo. En el examen macroscópico, los carcinomas basaloides son similares a los carcinomas de células escamosas queratinizantes típicos. Microscópicamente, se caracterizan por nidos y cordones anastomosados de células escamosas inmaduras de tamaño variable con poca o ninguna maduración escamosa. Las células de tipo basal dentro de los nidos y cordones se asemejan a las del tipo clásico de carcinoma in situ del cuello uterino.
- Carcinoma Condilomatoso (Warty Carcinoma): Forma parte del espectro de carcinomas escamosos HPV- asociado[1]. Se caracteriza por presentar proyecciones papilares con núcleos fibrovasculares revestidos por un epitelio bien polarizado que presentan efecto citopático viral- coilocitos-, aunque con una atipia citológica severa, actividad mitótica elevada y presencia de figuras mitóticas atípicas. El patrón de invasión es típicamente expansivo con nidos confluentes y de formas irregulares en el estroma subyacente. En algunos casos, puede ser difícil identificar la invasión estromal definitiva, pero la desmoplasia focal, las perlas de queratina profundamente asentadas y la atipia citológica marcada son pistas histológicas útiles.
- Carcinoma Verrucoso: Forma parte del espectro de carcinomas escamosos HPV independientes[1]. Sin embargo, suelen presentar marcación conservada (“wildtype”) con técnicas de inmunohistoquímica para p53 y el DE-VIL representa la precursora putativa.
Es una variante localmente agresiva poco común del carcinoma de células escamosas sin potencial metastásico. El carcinoma verrugoso se presenta comúnmente en pacientes de edad avanzada y se asocia con inflamación vulvar crónica. Estos tumores son típicamente grandes y exofíticos, pero pueden invadir profundamente como grandes nidos bulbosos con frentes anchos que imparten una arquitectura de verruciforme. Por definición, hay falta de coilocitos y atipia nuclear en todo el espesor del epitelio incluida la interfaz epitelio-estromal. Dada su citomorfología blanda, las biopsias superficiales de esta lesión a menudo se diagnostican erróneamente como no tumorales. Es importante destacar que si existe algún grado de invasión infiltrativa, el tumor debe designarse como carcinoma de células escamosas queratinizante HPV independiente que surge en un contexto de un carcinoma verrucoso [6].
Informe histopatológico:
El Colegio Americano de Patólogos (CAP) [3] ha desarrollado recomendaciones para unificar la información incluida en los informes de patología de los Carcinomas escamosos de la vulva. Los elementos esenciales que no debieran faltar en los informes histopatológicos de resección se enumeran en la Tabla 3.
La realización de informes histopatológicos sinópticos mejora la completitud, precisión y facilidad de creación del informe y permite al médico tratante extraer datos del informe los datos de manera rápida y precisa para el correcto diagnóstico y tratamiento de las pacientes.
Bibliografía
- WHO, editor. WHO Classification of Tumours of Female Reproductive Organs. 5th Editio. WHO Classification of Tumours Editorial Board 2020.
- McAlpine JN, Leung SCY, Cheng A, et al. Human papillomavirus (HPV)-independent vulvar squamous cell carcinoma has a worse prognosis than HPV-associated disease: a retrospective cohort study. Histopathology 2017;71:238–46. doi:10.1111/his.13205
- Rakislova N, Clavero O, Alemany L, et al. "Histological characteristics of HPV-associated and -independent squamous cell carcinomas of the vulva: A study of 1,594 cases”. Int J Cancer 2017;141:2517–27. doi:10.1002/ijc.31006
- Riethdorf S, Neffen EF, Cviko A, et al. p16INK4A expression as biomarker for HPV 16-related vulvar neoplasias. Hum Pathol 2004;35:1477–83. doi:10.1016/j.humpath.2004.09.004
- Nooij LS, Ter Haar NT, Ruano D, et al. Genomic characterization of vulvar (pre)cancers identifies distinct molecular subtypes with prognostic significance. Clin Cancer Res 2017;23:6781–9. doi:10.1158/1078-0432.CCR-17-1302
- Watkins JC. Human Papillomavirus–Independent Squamous Lesions of the Vulva. Surg Pathol Clin 2019;12:249–61. doi:10.1016/j.path.2019.01.001
- Singh N, Gilks CB. Vulval squamous cell carcinoma and its precursors. Histopathology 2020;76:128–38. doi:10.1111/his.13989
Tablas y Figuras
Tabla 1. Carcinoma de células escamosas vulvar asociado al virus del papiloma humano (VPH) vs independiente del VPH-
|
Carcinoma Escamoso de la vulva |
HPV relacionado |
HPV independiente |
|
Edad |
4°-6° década |
5°- 7° década |
|
Etiología |
Infección por HPV de alto riesgo |
Inflamación crónica (liquen escleroso) |
|
Multifocalidad |
Frecuente |
Infrecuente |
|
Asociación con SIL multifocal del tracto genital inferior |
Frecuente |
Infrecuente |
|
Precursor |
HSIL |
dVIN (o DEVIL) |
|
Pronóstico |
Favorable |
Menos favorable |
|
Sensibilidad a la radioterapia |
Sensible? |
Menos sensible? |
Adaptado de Singh N, et al. Histopathology 2020 [7]
Tabla 2. Modelo de 3 vías de patogénesis del carcinoma escamoso de vulva

Tabla 3: Elementos esenciales* del informe sinóptico de los carcinomas de células escamosas de vulva.
|
Tipo y tamaño de muestra |
|
Procedimiento |
|
Sitio, tamaño, grosor y multifocalidad |
|
Tipo y grado histológico |
|
Profundidad de la invasión |
|
Órganos/ tejidos adyacentes afectados |
|
Estado de margen |
|
Invasión linfática / vascular |
|
Estado de los ganglios linfáticos |
|
Estadificación- descriptores del TNM |
*Elementos esenciales: datos básicos requeridos en los informes histopatológicos para describir adecuadamente las neoplasias malignas. Los datos esenciales deben informarse en todos los casos, incluso si la respuesta es "no aplicable" o "no se puede determinar".
Figura1. (A) Microfotografía de Carcinoma escamoso infiltrante HPV- asociado (H&E: 10X). (B) Con marcación positiva, en bloque con técnica de inmunohistoquímica para p16.

Figura 2. (A)Microfotografía de Carcinoma escamoso infiltrante HPV- independiente (H&E: 10X). (B) Con marcación positiva, nuclear intensa con técnica de inmunohistoquímica para p53.
